- Sustancias puras y mezclas
- Separación de mezclas
- Mezclas homogéneas: disoluciones
- Sustancias en la vida cotidiana
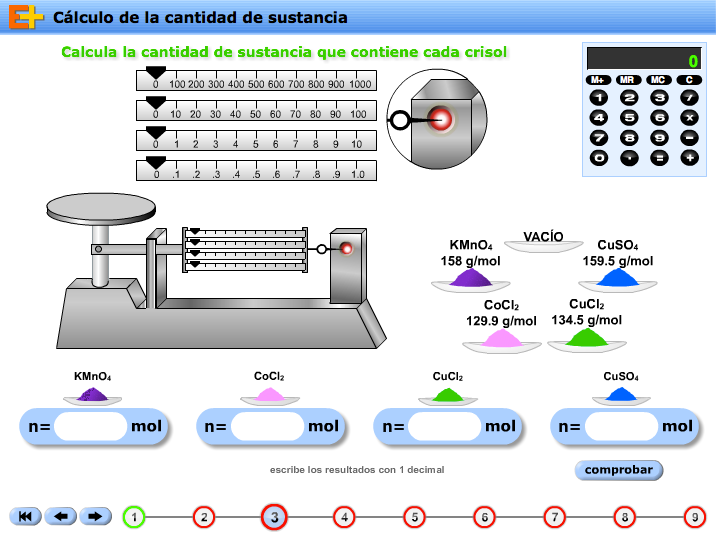
- Teoría atómico-molecular de Dalton
- Enlazando con la unidad anterior...
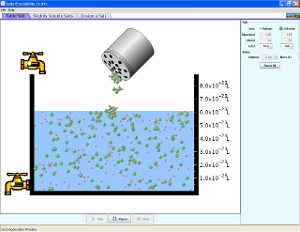
- Clasificación de los sistemas materiales:


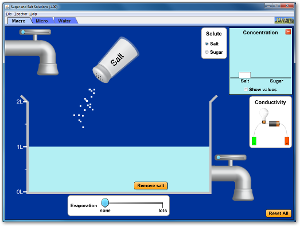
Disoluciones de sal y azúcar
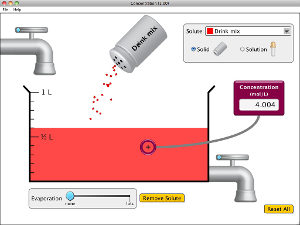
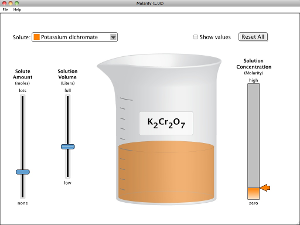
Concentración
Ejercicios con lupa ACME de "efecto túnel"
Métodos de separación
1. Filtración
2. Destilación (destilación fraccionada del aire)
3. Cromatografía
Gracias al Dr. John Pollard y colaboradores por sus animaciones