View more presentations or Upload your own.
Para practicar no hay nada mejor que esta animación de Educaplus...
1. Principio de exclusión de Pauli: los orbitales sólo pueden tener:
- 0 electrones (vacíos)
- 1 electrón (semiocupado)
- 2 electrones con sus espines opuestos (completo)
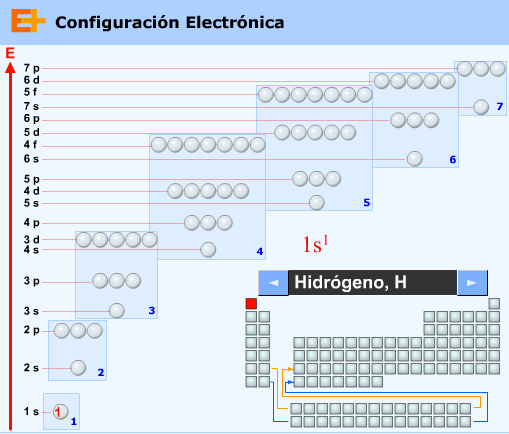
- Primero llenamos los de menor n+l
- En caso de empate, llenaremos primero aquellos que tengan menor valor de n
n+l Rule for Atomic Electron Configurations from the Wolfram Demonstrations Project by S. M. Blinder
Este principio se resume en la regla de Moeller (o regla de las diagonales)
3. Principio de máxima multiplicidad de Hund: los orbitales de igual valor de l, primero se semi-ocupan, y después se van ocupando (apareando electrones). La regla se resume diciendo que los orbitales del mismo tipo, prefieren tener el mayor número posible de electrones desapareados.
Los orbitales s se ocuparán :
- (1)
- (2)
- m=-1, 0, +1
- (1, 0, 0)
- (1, 1, 0)
- (1, 1, 1)
- (2, 1, 1)
- (2, 2, 1)
- (2, 2, 2)
- m=-2, -1, 0, +1, +2
- (1, 0, 0, 0, 0)
- (1, 1, 0, 0, 0)
- (1, 1, 1, 0, 0)
- (1, 1, 1, 1, 0)
- (1, 1, 1, 1, 1)
- (2, 1, 1, 1, 1)
- (2, 2, 1, 1, 1)
- (2, 2, 2, 1, 1)
- (2, 2, 2, 2, 1)
- (2, 2, 2, 2, 2)
| Tipo | Valor de l | Valores de m | ¿Cuántos hay? | Que se identifican... | Formas |
| s |
0 |
0 | uno | no hay | |
| p |
1 |
-1, 0, +1 | tres | x, y, z | |
| d |
2 |
-2, -1, 0, +1, +2 | cinco | otros subíndices que aluden a su orientación y forma |
|
| f |
3 |
-3, -2, -1, 0, +1, +2, +3 | siete | otros subíndices que aluden a su orientación y forma |
Esta ordenación de elementos nos permitirá construir cada bloque del sistema periódico:




No hay comentarios:
Publicar un comentario