Contenidos
1. Cambios físicos y químicos2. Las reacciones químicas
Espectaculares
3. Medida de la cantidad de materia: masa, moles, moléculas y átomos
4. La ecuación química
5. Cálculos en las reacciones químicas
Cantidad de materia: masa, moles, moléculas y átomos
En Química, las cantidades de una sustancia pura, es decir la cantidad de materia en estado sólido, líquido o gaseso, se pueden expresan en CUATRO idiomas diferentes:
- Masa (gramos), que a través de la densidad, podemos calcular si conocemos el volumen.
- n= n º de moles, o sencillamente moles de la sustancia pura.
- nº de moléculas
- nº de átomos de cada elemento que interviene en la fórmula molecular de la sustancioa pura.
- Masa (gramos), que a través de la densidad, podemos calcular si conocemos el volumen.
- n= n º de moles, o sencillamente moles de la sustancia pura.
- nº de moléculas
- nº de átomos de cada elemento que interviene en la fórmula molecular de la sustancioa pura.
Reacciones químicas
Uno de los problemas más frecuentes con que nos encontramos a la hora de realizar los problemas de estequiometría, es no tener claros algunos conceptos, y en el orden en que tienen que intervenir.En todos los casos hay que tener en cuenta este protocolo:
1. La ecuación química ha de estar AJUSTADA.
2. Las cantidades que intervienen en la reacción química son PURAS. Para conocer las cantidades puras que intervienen he de tener en cuenta:
- En un mineral, la riqueza en el reactivo: óxido, metal, etc.
- En una disolución, la concentración en cualquiera de sus formas, nos dirá qué cantidad de soluto intervendrá.
- En una mezcla de gases, el % en volumen del reactivo
4. Para saber por dónde comenzamos a realizar cálculos, hemos de reconocer quién es el REACTIVO EN EXCESO (sobrará cuando finalice la reacción) y quién es el REACTIVO LIMITANTE (cuando se acaba este reactivo, la reacción finaliza)
Para ello es una buen idea pensar en el curso o desarollo de la reacción en términos de moles de cada reactivo al inicio, durante y al final de la reacción, teniendo en cuenta los coeficientes de ajuste de la reacción...
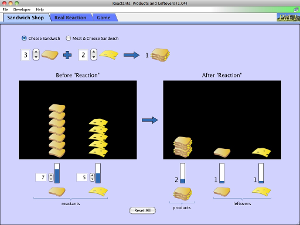
Observa este ejemplo general en el que partimos de 10 moles de A y 12 moles de B:

Reactivo limitante y reactivo en exceso
5. Realizamos los cálculos estequiométricos (con la ecuación química) A PARTIR DE LOS MOLES DEL REACTIVO LIMITANTE.
6. Convertimos los productos o reactivos obtenidos a las canidades impuras en que estén contenidos.






1 comentario:
:)
Publicar un comentario